
9. Fluor (F) <— 10. Neon (Ne) —> 11. Natrium (Na)
https://sv.wikipedia.org/wiki/Neon
https://en.wikipedia.org/wiki/Neon
Generella egenskaper
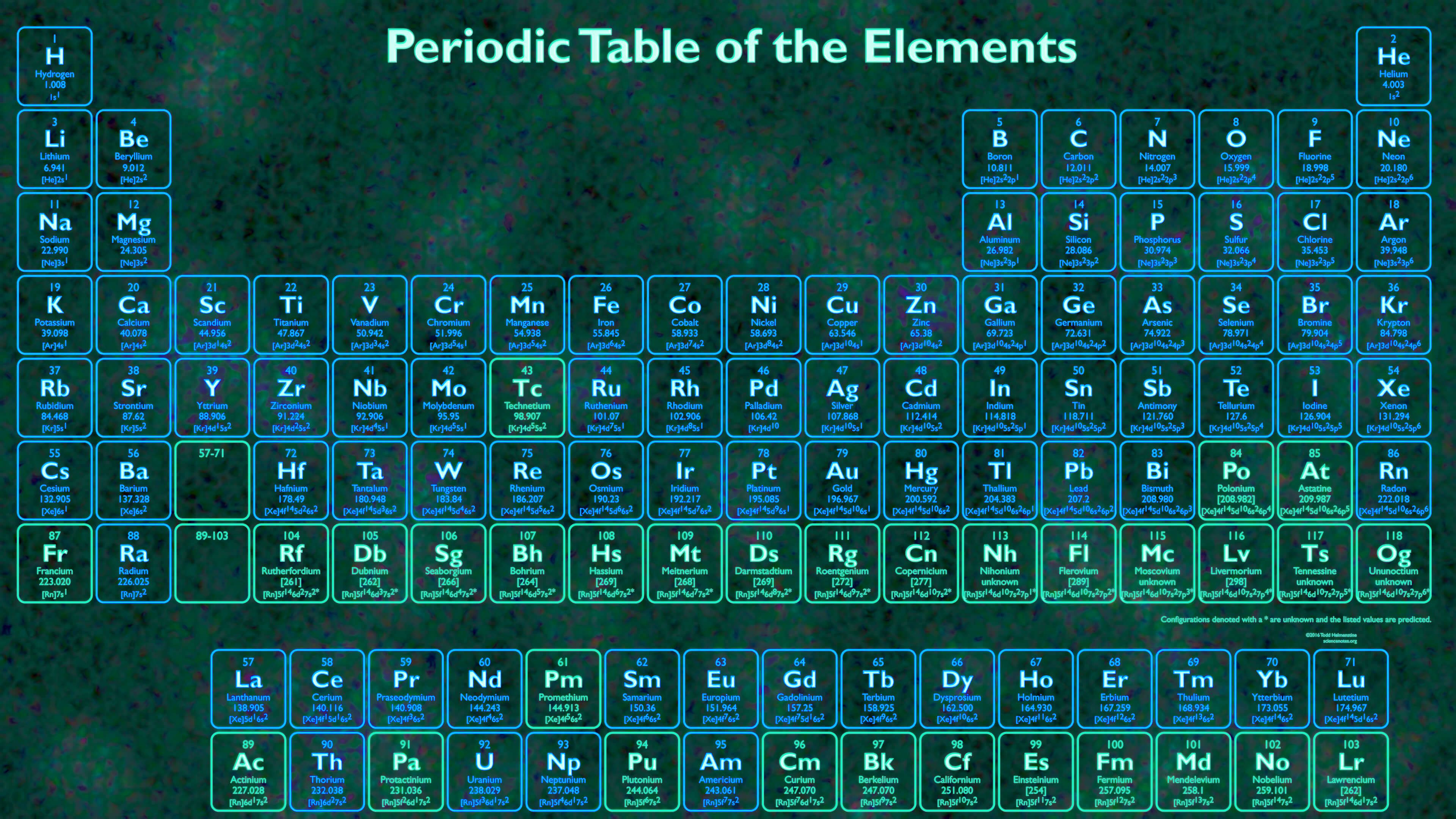
Relativ atommassa: 20,1797 u
Utseende: Färglös i gasform
Fysikaliska egenskaper
Densitet 0,9002 g/L
Densitet (flytande, vid kokpunkten): 1,207 g/cm3
Aggregationstillstånd: Gas
Smältpunkt: 24,56 K (−248,59 °C)
Kokpunkt: 27,104 K (−246,046 °C)
Trippelpunkt: 24,556 K (−248,594 °C) 43,37 kPa
Kritisk punkt: 44,4918 K (−228,6582 °C)
Molvolym: 13,23 × 10−6 m3/mol
Smältvärme: 0,335 kJ/mol
Ångbildningsvärme: 1,71 kJ/mol
Specifik värmekapacitet: 1 031 J/(kg × K)
Molär värmekapacitet: 20,79 J/(mol × K)
Atomära egenskaper
Atomradie: 38 pm
Kovalent radie: 69 pm
van der Waalsradie: 154 pm
Elektronaffinitet: 0 kJ/mol
Elektronkonfiguration
Elektronkonfiguration: [He] 2s2 2p6
e− per skal: 2, 8
Kemiska egenskaper
Oxidationstillstånd: 0
Elektronegativitet (Allenskalan): 4,789
Diverse
Kristallstruktur: Kubisk ytcentrerad (fcc)
Ljudhastighet: 435 m/s
Värmeledningsförmåga: 0,0491 W/(m × K)
Magnetism: Diamagnetisk
Magnetisk susceptibilitet: −3,8 × 10−9
Brytningsindex: 1,000067
Identifikation
CAS-nummer: 7440-01-9
EG-nummer: 231-110-9
Pubchem: 23935
RTECS-nummer: QP4450000
Historia
Namnursprung: Från grekiska oxy-, både ’form’ och ’syra’, och -gen, vilket betyder ”syrabildande”.
Upptäckt: Carl Wilhelm Scheele (1772)
Namngivare: Antoine Lavoisier (1777)
Isotoper
| Nuklid | Förekomst | Halveringstid (t1/2) | Sönderfall | Sönderfallsprodukt | |
|---|---|---|---|---|---|
| 18Ne | {syn.} | 1,672 s | ε 2p | 18F 16O | |
| 19Ne | {syn.} | 17,296 s | β+ | 19F | |
| 20Ne | 90,48 % | Stabil | |||
| 21Ne | 0,27 % | Stabil | |||
| 22Ne | 9,25 % | Stabil | |||
| 23Ne | {syn.} | 37,24 s | β− | 23Na | |
| 24Ne | {syn.} | 3,38 min | β− | 24Na |
https://en.wikipedia.org/wiki/Isotopes_of_neon
Neon
Neon är ett icke-metallisktgrundämne som har kemiskt tecken[15]Ne och atomnummer 10. Neon är en ädelgas, som bland annat används i lysrör. När ett neonlysrör lyser blir ljuset rött till orange, men neon kan blandas med andra ädelgaser som till exempel krypton för att få andra färger.
Egenskaper

Glödande ultrarent neon.
Neonets trippelpunkt är 24,5561 K, vilket är en fixpunkt i International Temperature Scale of 1990.
Historik

Ett neonfyllt glasrör lyser upp med hjälp av elektrisk ström och bildar förkortningen för neon.
Neon upptäcktes år 1898 av Sir William Ramsay och den 20 år yngre Morris Travers. De försökte från början framställa en ädelgas med en atomvikt på cirka 20 genom att försiktigt avdunsta syre och kväve från flytande luft och sedan granska gasen som var kvar, men istället hittade de en gas med atomvikten 84, det vill säga krypton. De trodde då att gasen med atomvikten 20 hade förångats med syret och kvävet. De försökte igen genom att framställa tre liter argon och sedan föra ned behållaren (med argonen) i flytande luft, reducera trycket och ta vara på den gas som avdunstade först. När urladdningen vid en spektralanalys av provet gick genom röret lyste gasen med en karmosinröd färg. När de sedan gjorde an spektralanalys på gasen visade det sig att den hade många linjer i det röda våglängdsområdet och några få gröna och violetta.
När de skulle namnge gasen frågade Ramsay sin trettonåriga son och han sade prompt ”Novium – för den är ju ny”. Ramsay tyckte om förslaget, men tyckte att ”neon” som kommer från grekiska ordet ”neos” som också betyder ’ny’ – passade bättre med de redan namnbestämda argon och krypton.
Utvinning
Eftersom neon har en så låg kokpunkt (-246,08 °C) utvinns den som de flesta andra ädelgaser (utom helium) genom fraktionerad destillation av flytande luft.
| Gas | Kokpunkt (°C) | Procentandel av luft |
|---|---|---|
| Neon | −246,08 | 0,0000153 |
| Argon | −185,9 | 0,934 |
| Krypton | −152,3 | 0,000001 |
| Xenon | −107,1 | 0,00000005 |
| Syre | −183,0 | 20,947 |
| Kväve | −195,8 | 78,084 |
Användning

Neon används främst som gasfyllnad i lysrör som används för ljusreklam och prydnad. Vid tillverkning av neonlysrör fylls röret med neon till olika millibartryck beroende på rörets diameter och elektroder sätts fast i ändarna. Vid tändning läggs en spänning på i Sverige upp till 10 000 volt över elektroderna. (dispens för 12 000 V kan utfärdas). För ett rött neonrör med diameter 17mm och längd 2 meter är tändspänningen 1600 volt och driftspänningen 850 volt. Neonet ger ett rött sken. Vill man ha andra färger används främst gasen argon vilken är blålysande. Där kan man med tillsatser av färgpulver och användade av filterglas få valfri färg. Kvicksilver används för att uppnå ultraviolett ljus i kombination med ljuspulver, även om rött också framställs med argon i filterglas. Det finns inget kvicksilver i ett neonrör fyllt med just neon.
Neon används ofta kommersiellt i elektronrör, i överspänningsskydd och i flytande form som kylmedium.

| H-fraser | H280 |
|---|---|
| P-fraser | P403 |
http://www.periodicvideos.com/

 5′-deoxi-5′-fluoradenosin + L-metionin
5′-deoxi-5′-fluoradenosin + L-metionin






























































































































































































































































































































































































































































































































































































































































Kommentarer