
76. Osmium (Os) <— 77. Iridium (Os) —> 78. Platina (Pt)
https://sv.wikipedia.org/wiki/Iridium
https://en.wikipedia.org/wiki/Iridium
Blogg, dagbok och hemsida

76. Osmium (Os) <— 77. Iridium (Os) —> 78. Platina (Pt)
https://sv.wikipedia.org/wiki/Iridium
https://en.wikipedia.org/wiki/Iridium

75. Rhenium (Re) <— 76. Osmium (Os) —> 77. Iridium (Ir)
https://sv.wikipedia.org/wiki/Osmium
https://en.wikipedia.org/wiki/Osmium
Relativ atommassa: 190,23 u
Utseende: Blåaktigt grå
Densitet (vid rumstemperatur): 22.59 g/cm3
Densitet (vid smältpunkten): 20 g/cm3
Aggregationstillstånd: Fast
Smältpunkt: 3 306 K (3 033 °C)
Kokpunkt: 5 285 K (5 012 °C)
Molvolym: 8,42 × 10-6 m3/mol
Smältvärme: 31,8 kJ/mol
Ångbildningsvärme: 627,6 kJ/mol
Molär värmekapacitet: 24.7 J/(mol·K)
Atomradie: 130 (185) pm
Kovalent radie: 128 pm
Elektronkonfiguration: [Xe] 4f14 5d6 6s2
e− per skal: 2, 8, 18, 32, 14, 2
Oxidationstillstånd: −4, −2, −1, 0, +1, +2, +3, +4, +5, +6, +7, +8
Oxider (basicitet): Svag syra
Kristallstruktur: Hexagonal
Ljudhastighet: 4 950 m/s
Termisk expansion: 5.1 µm/(m⋅K) (at 25 °C)
Värmeledningsförmåga: 87.6 W/(m⋅K)
Elektrisk konduktivitet: 10,9 × 106 A/(V × m)
Elektrisk resistivitet: 81.2 nΩ⋅m (at 0 °C)
Magnetism: Paramagnetisk
Magnetisk susceptibilitet: 11×10−6 cm3/mol
Skjuvmodul: 222 GPa
Bulks modul: 462 GPa
Poissons konstant: 0.25
Mohs hårdhet: 7
Vickers hårdhet: 300 MPa
Brinells hårdhet: 293 MPa
CAS-nummer: 7440-04-2
Upptäckt och första isolation: Smithson Tennant (1803)
| Isotop | Förekomst | Halveringstid (t1/2) | Sönderfall | Sönderfallsprodukt |
|---|---|---|---|---|
| 184Os | 0.02% | Stabil | ||
| 185Os | {syn} | 93.6 d | ε | 185Re |
| 186Os | 1.59% | 2.0×1015 y | α | 182W |
| 187Os | 1.96% | Stabil | ||
| 188Os | 13.24% | Stabil | ||
| 189Os | 16.15% | Stabil | ||
| 190Os | 26.26% | Stabil | ||
| 191Os | {syn} | 15.4 d | β− | 191Ir |
| 192Os | 40.78% | Stabil | ||
| 193Os | {syn} | 30.11 d | β− | 193Ir |
| 194Os | {syn} | 6 y | β− | 194Ir |
Osmium är ett metalliskt grundämne som tillhör gruppen tunga platinametaller. Det används som katalysator och i legeringar. Ämnet upptäcktes 1804 av den engelske kemisten Tennant.
Osmium har den högsta naturliga densiteten av alla grundämnen. Osmium är en spröd, extremt hård, blågrå metall. Bland annat på grund av sin stora hårdhet används metallen inom tekniken till exempelvis reservoarpennor och nålar för tonhuvud samt som katalysatorer och lageraxlar.
Osmium har fått sitt namn från grekiskans osmí som betyder ”lukt”. När osmium reagerar med syre i luften bildas osmiumtetroxid OsO4, som är giftig, illaluktande och frätande.
Osmium är sällsynt förekommande i naturen, men kan hittas naturligt legerat med iridium (s.k. iridosmium eller osmiridium) i flodsandsavlagringar i bl. a. Sydafrika, Uralregionen och Nordamerika.
År 1804 upptäckte en vetenskapsman i London, Smithson Tennant, grundämnet osmium.
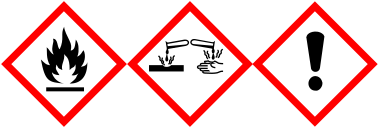
| H-fraser | H228, H315, H318, H335 |
| P-fraser | P210, P261, P280, P305 + P351 + P338 |

74. Wolfram (W) <— 75. Rhenium (Re) —> 76. Osmium (Os)
https://sv.wikipedia.org/wiki/Rhenium
https://en.wikipedia.org/wiki/Rhenium
Relativ atommassa: 186,21 u
Utseende: Gråaktigt vit
Densitet (vid rumstemperatur):
Densitet (vid smältpunkten):
Aggregationstillstånd: Fast
Smältpunkt: 3 459 K (3 186 °C)
Kokpunkt: 5 869 K (5 596 °C)
Molvolym: 8,86 × 10-6 m3/mol
Smältvärme: 33,2 kJ/mol
Ångbildningsvärme: 715 kJ/mol
Molär värmekapacitet: 25.48 J/(mol·K)
Atomradie: 135 (188) pm
Kovalent radie: 159 pm
Elektronkonfiguration: [Xe] 4f14 5d5 6s2
e− per skal: 2, 8, 18, 32, 13, 2
Oxidationstillstånd: −3, −1, 0, +1, +2, +3, +4, +5, +6, +7
Oxider (basicitet): Svag syra
Elektronegativitet (Paulingskalan): 1.9
Kristallstruktur: Hexagonal
Ljudhastighet: 4700 m/s
Termisk expansion: 6.2 µm/(m⋅K)
Värmeledningsförmåga: 48.0 W/(m⋅K)
Elektrisk konduktivitet: 5,42 × 106 A/(V × m)
Elektrisk resistivitet: 193 nΩ⋅m (at 20 °C)
Magnetism: Paramagnetisk
Magnetisk susceptibilitet: +67.6×10−6 cm3/mol (293 K)
Youngs modul: 463 GPa
Skjuvmodul: 178 GPa
Bulks modul: 370 GPa
Poissons konstant: 0.30
Mohs hårdhet: 7
Vickers hårdhet: 1350–7850 MPa
Brinells hårdhet: 1320–2500 MPa
CAS-nummer: 7440-15-5
Namnursprung: Efter floden Rhine (German: Rhein)
Upptäckt: Walter Noddack, Ida Noddack, Otto Berg (1925)
Första isolation: Walter Noddack, Ida Noddack (1928)
| Isotop | Förekomst | Halveringstid (t1/2) | Sönderfall | Sönderfallsprodukt |
|---|---|---|---|---|
| 185Re | 37.4% | Stabil | ||
| 187Re | 62.6% | 4.12×1010 y | β− | 187Os |
https://en.wikipedia.org/wiki/Isotopes_of_rhenium
Rhenium är ett metalliskt grundämne som har kemiskt tecken Re och atomnumret 75. Rhenium är ganska sällsynt men erhålls ur slaggprodukter från molybden-framställning.
Rent rhenium är en hård, ljusgrå, glänsande metall som liknar platina. I kompaktform angrips den av luftens syre först vid temperaturer över 1 000 °C. I finfördelad form oxideras den redan vid rumstemperatur i luft.
Rhenium har den näst högsta kokpunkten (5 627 °C) av alla grundämnen efter volfram (5 927 °C). Rhenium har även den tredje högsta smältpunkten (3 186 °C) efter kol (3 422 °C) och volfram (3 407°C).
Walter Noddack och Ida Tacke (blivande makarna Noddack) började år 1922 leta efter grundämnena nummer 43 (teknetium) och 75 (rhenium). Makarna Noddack utvann 1 mg oxid av det de trodde var grundämne nummer 75 ur platinamalm, och genom röntgenemissionspektroskopi hittade man linjer som tillhörde grundämne nummer 75. Sedan offentliggjorde makarna Noddack upptäckten av grundämne nummer 75 och kallade det rhenium efter floden Rhen. År 1929 upptäckte man att rhenium fanns i en halt av 2–4 mg per kg i molybdenglans och kunde därför utvinnas ur slaggprodukter vid molybdenframställning.
Det produceras cirka 20 ton rhenium per år (1995). Så stor mängd förbrukas dock inte varför en stor del av produktionen läggs i lager.
Rhenium används tillsammans med platina som katalysator i bilar för att bli av med kväveoxider, kolmonoxid och aromatiska kolväten från avgaserna. Rhenium används även i legeringar med nickel som används i jetmotorer. På grund av sin temperaturbeständighet, elasticitet och mekaniska hållfasthet används den också i termoelement, elektronrör, elektriska kontakter, glödtrådar m. m.
Rhenium finns i en medelhalt i jordskorpan av 4×10-4 ppm och i haven av 4×10-6. Rhenium förekommer mest tillsammans med molybden men även i platinamalm, columbit och gadolinit.
Rhenium framställs ur molybdenglans genom rostning av sulfiderna då molybden(VI)oxid (MoO3) och rhenium(VII)oxid (Re2O7) bildas. Sedan hettas oxidblandningen upp till 625 °C och sedan avgår rheniumoxiden som ånga och samlas upp.

| H-fraser | H228 |
| P-fraser | P210, P240, P241, P280, P370 + P378 |

73. Tantal (Ta) <— 74. Wolfram (W) —> 75. Rhenium (Re)
https://sv.wikipedia.org/wiki/Volfram
https://en.wikipedia.org/wiki/Tungsten
Relativ atommassa: 183,84 u
Utseende: Grå-vit glänsande
Densitet (vid rumstemperatur): 19.3 g/cm3
Densitet (vid smältpunkten): 17.6 g/cm3
Aggregationstillstånd: Fast
Smältpunkt: 3 695 K (3 422 °C)
Kokpunkt: 5 828 K (5555 °C)
Molvolym: 9,47 × 10-6 m3/mol
Värmevärde:
Smältvärme: 35,4 kJ/mol
Ångbildningsvärme: 824 kJ/mol
Molär värmekapacitet: 24.27 J/(mol·K)
Atomradie: 135 (193) pm
Kovalent radie: 146 pm
Elektronkonfiguration: [Xe] 4f14 5d4 6s2
e− per skal: 2, 8, 18, 32, 12, 2
Oxidationstillstånd: −4, −2, −1, 0, +1, +2, +3, +4, +5, +6
Oxider (basicitet): Mild syra
Elektronegativitet (Paulingskalan): 2.36
Kristallstruktur: kubisk rymdcentrerad packning
Ljudhastighet: 5174 m/s
Termisk expansion: 4.5 µm/(m⋅K) (at 25 °C)
Värmeledningsförmåga: 173 W/(m⋅K)
Elektrisk konduktivitet: 18,9 × 106 A/(V × m)
Elektrisk resistivitet: 52.8 nΩ⋅m (at 20 °C)
Magnetism: Paramagnetisk
Magnetisk susceptibilitet: +59.0×10−6 cm3/mol (298 K)
Youngs modul: 411 GPa
Skjuvmodul: 161 GP
Bulks modul: 310 GPa
Poissons konstant: 0.28
Mohs hårdhet: 7,5
Vickers hårdhet: 3430–4600 MPa
Brinells hårdhet: 2000–4000 MPa
CAS-nummer: 7440-33-7
Namnursprung: W”: from Wolfram, originally from Middle High German wolf-rahm ’wolf’s foam’ describing the mineral wolframite
Upptäckt och första isolation: Juan José Elhuyar and Fausto Elhuyar (1783)
| Isotop | Förekost | Halveringstid (t1/2) | Sönderfall | Sönderfallsprodukt |
|---|---|---|---|---|
| 180W | 0.12% | 1.8×1018 y | α | 176Hf |
| 181W | {syn} | 121.2 d | ε | 181Ta |
| 182W | 26.50% | Stabil | ||
| 183W | 14.31% | Stabil | ||
| 184W | 30.64% | Stabil | ||
| 185W | {syn} | 75.1 d | β− | 185Re |
| 186W | 28.43% | Stabil |
https://en.wikipedia.org/wiki/Isotopes_of_tungsten
Volfram är ett metalliskt grundämne som upptäcktes 1783 av Carl Wilhelm Scheele. Volfram har den högsta smältpunkten av alla metaller och används därför bland annat i glödlampor.

Metallen volfram upptäcktes 1783 av de spanska bröderna J.J. och Don F. de Elhuyar, när de lyckades reducera och få fram en oren metall. Två år tidigare hade Carl Wilhelm Scheele varit det nya grundämnet på spåren när han påvisat den dittills okända ”tungstenssyran”. Scheele var den som offentliggjorde spanjorernas slutliga upptäckt och den som med viss orätt kom att bli förknippad med upptäckten. Mineralet scheelit, där ”tungstenssyran” ingick, var redan känt och hade 1751 fått namnet tungsten på grund av sin höga densitet.
Tidigare hade ett annat mineral i tysk bergshantering kallats Wolfram (”vargfradga”), och ”volfram” var det namn bröderna de Elhuyar gav sitt nya grundämne. Scheeles tungsten blev också en spridd benämning, men numera syftar tungsten i svenska språket enbart på scheelit. På engelska kallas grundämnet dock fortfarande tungsten, och motsvarande ord finns på bland annat franska, portugisiska, italienska, turkiska och hebreiska. Symbolen W och det nutida svenska namnet volfram kommer från tyska ”Wolf Rahm”. Det tyska namnet syftar på det ”varglika” sätt på vilket grundämnet reagerade med smält tenn.
Volframs mest kännetecknande egenskap är dess höga smältpunkt, 3 695 Kelvin, den högsta bland alla metaller och näst högst bland alla grundämnen. Kokpunkten är 5 828 Kelvin, vilket är högst av alla grundämnen. Volfram har också en anmärkningsvärt hög dragstyrka, ungefär 2 000–3 500 MPa vid 25 °C.
Volfram är den enda metallen från den tredje övergångsmetallserien som förekommer i biomolekyler. Volfram är också det tyngsta kända ämnet som används av levande organismer.

Volfram används främst vid metallbearbetning och gruvdrift samt till byggnadsmaskiner. Oftast används då väldigt hårda volframkarbider som WC och W2C. Det näst största användningsområdet är i lampor och andra elektriska tillämpningar. Eftersom volfram tål mycket höga temperaturer används det i glödtrådar till glödlampor men även i elektroder för TIG-svetsning. Kalcium- och magnesiumvolframater kan också användas i lysrör. Wolframlampor används flitigt i spektrofotometer, då det är en utmärkt källa till kontinuerligt synlig och infraröd strålning, med användbar strålning i våglängderna 320–2 500 nm. Ferrovolfram används ofta till legering och man använder det till stålverktyg och snabbstål.
Volfram är ett mycket sällsynt grundämne. Halten av ämnet i jordskorpan är endast cirka 1 g/ton. Ämnet förekommer också endast i låga koncentrationer i jordens hydro- och biosfärer. Halten i havsvatten är endast cirka 0,1 mg/ton.
Ungefär hälften av världens volframtillgångar finns i Kina. Också Ryssland, USA, Kanada, Sydkorea och Bolivia har betydande tillgångar. Scheelit har i Sverige brutits bland annat i gruvan i Yxsjöberg.
Volfram förekommer inte i ren form i naturen. Den främsta gruppen av volframföreningar är volframaterna. Förutom volframaterna känner man även till några sulfider, ett silikat och en oxyklorid, men dessa är väldigt sällsynta. De ekonomiskt mest viktiga volframmineralen är scheelit och volframit.

| H-fraser | H315, H319 |
| P-fraser | P264, P280 |

72. Hafnium (Hf) <— 73. Tantal (Ta) —> 74. Wolfram (W)
https://sv.wikipedia.org/wiki/Tantal
https://en.wikipedia.org/wiki/Tantalum
Relativ atommassa: 180,947 9 u
Utseende: Grå-blå
Densitet (vid rumstemperatur): 16.69 g/cm3
Densitet (vid smältpunkten): 15 g/cm3
Aggregationstillstånd: Fast
Smältpunkt: 3 290 K (3 017 °C)
Kokpunkt: 5 731 K (5 458 °C)
Molvolym: 10,85 × 10-6 m3/mol
Smältvärme: 31,6 kJ/mol
Ångbildningsvärme: 743 kJ/mol
Specifik värmekapacitet:
Molär värmekapacitet: 36.57 kJ/mol
Atomradie: 145 (200) pm
Kovalent radie: 138 pm
Elektronkonfiguration: [Xe] 4f14 5d3 6s2
e− per skal: 2, 8, 18, 32, 11, 2
Oxidationstillstånd: −3, −1, 0, +1, +2, +3, +4, +5
Oxider (basicitet): Svag syra
Elektronegativitet (Paulingskalan): 1,5
Kristallstruktur: Kubisk
Ljudhastighet: 3 400 m/s
Termisk expansion: 6.3 µm/(m⋅K) (at 25 °C)
Värmeledningsförmåga: 57.5 W/(m⋅K)
Elektrisk konduktivitet: 7,61 × 106 A/(V × m)
Elektrisk resistivitet: 131 nΩ⋅m (at 20 °C)
Magnetism: Paramagnetisk
Magnetisk susceptibilitet: +154.0×10−6 cm3/mol (293 K)
Youngs modul: 186 GPa
Skjuvmodul: 69 GPa
Bulks modul: 200 GPa
Poissons konstant: 200 GPa
Mohs hårdhet: 6½
Vickers hårdhet: 870–1200 MPa
Brinells hårdhet: 440–3430 MPa
CAS-nummer: 7440-25-7
Upptäckt: Anders Gustaf Ekeberg (1802)
Första isolation: Heinrich Rose (1844) (Recognized as a distinct element by)
| Isotop | Förekomst | Halveringstid (t1/2) | Sönderfall | Sönderfallsprodukt |
|---|---|---|---|---|
| 177Ta | {syn} | 56.56 h | ε | 177Hf |
| 178Ta | {syn} | 2.36 h | ε | 178Hf |
| 179Ta | {syn} | 1.82 y | ε | 179Hf |
| 180Ta | {syn} | 8.125 h | ε β− | 180Hf 180W |
| 180mTa | 0.012% | Stabil | ||
| 181Ta | 99.988% | Stabil | ||
| 182Ta | {syn} | 114.43 d | β− | 182W |
| 183Ta | {syn} | 5.1 d | β− | 183W |
https://en.wikipedia.org/wiki/Isotopes_of_tantalum
Tantal är ett sällsynt, duktilt, grått, glänsande och hårt metalliskt grundämne med mycket hög smältpunkt och hög korrosionsresistens. Tantal täcks spontant av ett skyddande oxidskikt vilket gör att metallen inte angrips av syror. Tantal används därför bland annat i kemisk apparatur. Denna egenskap har även gjort tantal till ett sedan 1960-talet efterfrågat ämne för tillverkning av högkvalitativa elektrolytkondensatorer, tantalelektrolytkondensatorer, gemenligen i kortform kallade tantalyter. Sådana kondensatorer används i all slags utrustning med elektronik, där krav på små dimensioner motiverar deras höga pris.
Tantal upptäcktes år 1802 av svensken Anders Gustaf Ekeberg i två prov, ett från Ytterby gruva på Resarö i Stockholms skärgård och ett från Kimito i Egentliga Finland, då en del av det svenska riket. Namnet han gav det nya ämnet anspelar på dess kemiska egenskap: ”Sjelfva recruten bland metallerne kallar jag TANTALUM, dels för at följa bruket, som gillar namn ur Mythologien, dels för at alludera på dess oförmögenhet at, midt i öfverflödet af syra, däraf taga något åt sig och mättas.” alltså namn efter den antika mytologins Tantalos.
Ett blandmineral som innehåller betydande halt tantal är tantalit. I blandmineralet ingår ofta det järnhaltiga mineralet tantalit-(Fe), tidigare kallad ferrotantalit samt manganhalig tantalit-(Mn) (tidigare manganotantalit). Dessutom kan tantal i blandmineralet ersättas av niob helt eller delvis som en fast lösning. Om niob överväger kallas den fasta lösningen columbit ((Fe,Mn)Nb2O6). Då det inte alltid går att på yttre kännetecken särskilja tantalit och columbit brukar de sammanfattas som coltan.
I tantalit kan tantalhalten uppgå till 58 % och då är niobhalten minst 1,5 %. I columbit kan tantalhalten vara låg medan niobhalten kan uppgå till 54,5 %.
Den snabba ökningen av efterfrågan på tantalmineral (coltan) under 1990-talet har lett till omfattande illegal utvinning i bland annat Kongo-Kinshasa, vilket resulterat i miljöförstöring och utgjort en drivkraft till militära konflikter.
Eftersom tantal har kemiska egenskaper liknande niobs förekommer de också ofta tillsammans i malmmineral för tantal. Några exempel på sådana malmmineral utöver de två ovan nämnda är:
Mikrolit (Ca,Na)2(Ta,Nb)2O6(OH,F)
Pyroklor (Ca,Na)2(Nb,Ta)2O6(OH,F)
Tanteuxenit-(Y) (Y,Ce,Ca,U,Th)(Ta,Nb,Ti)2O6
Euxenit (Y,Ca,Ce,U,Th)(Nb,Ta,Ti)2O6
Yttrotantalit-(Y) (Y,CaFe2+U,Th,)(Ta,Nb)O4
Samarskit (Y,Fe3+Fe2+U,Th,Ca)(Nb,Ta)O4
Tapiolit (Fe,Mn)(Ta,Nb)2O6
Fergusonit REE(Nb,Ta)O4 (REE=sällsynta jordartsmetaller)
Tantalit innehåller, förutom grundämnet tantal även en varierande mängd av grundämnet niob. Dessa två grundämnen är mycket lika och därmed svåra att separera. De kan dock skiljas åt med olika metoder. Traditionellt har framför allt två metoder använts. Den första bygger på att man överför niob och tantal till klorid-form (NbCl5 respektive TaCl5) varefter de skiljs och renas genom destillation. Den andra metoden bygger på fraktionerad kristallisation där metallerna överförs till fluoridform med fluorvätesyra och kaliumfluorid. Tantal bildar kaliumfluorotantalat (K2TaF7) som kristalliseras ut medan niob bildar ett oxifluoroniobat med högre löslighet som inte kristalliserar förrän pH ändras. Denna metod kom dock i mitten av 1900-talet att ersättas av metoder som bygger på vätskeextraktion. Det kan till exempel ske genom att mineral med de båda ämnena löses i till exempel fluorvätesyra, extraheras över till en organisk fas av till exempel metylisobutylketon, tributylfosfat eller 1-oktanol, och därefter selektivt extraheras tillbaka till en vattenfas och sedan fälls ut till exempel med hjälp av kaliumfluorid eller ammoniak. Denna princip har sedan vidareutvecklats till metoder där faserna separeras med membran.

| H-fraser | H228 |
| P-fraser | P210, P280, P370 + P378 |

71. Lutetium (Lu) <— 72. Hafnium (Hf) —> 73. Tantal (Ta)
https://sv.wikipedia.org/wiki/Hafnium
https://en.wikipedia.org/wiki/Hafnium
Relativ atommassa: 178.486(6) u
Utseende: Grå metallisk
Densitet (vid rumstemperatur): 0,08988 g/cm3
Densitet (vid smältpunkten): 70 g/dm3 (fast: 76,3 g/dm3)
Densitet (vid kokpunkten): 70,99 g/dm3
Aggregationstillstånd: Fast
Smältpunkt: 2 506 K (2 233 °C)
Kokpunkt: 4 876 K (4 603 °C)
Molvolym: 13,44 × 10-6 m3/mol
Smältvärme: 24,06 kJ/mol
Ångbildningsvärme: 575 kJ/mol
Molär värmekapacitet: 25.73 J/(mol·K)
Atomradie: 155 (208) pm
Kovalent radie: 175±10 pm
Elektronkonfiguration: [Xe] 4f14 5d2 6s2
e− per skal: 2, 8, 18, 32, 10, 2
Oxidationstillstånd: −2, 0, +1, +2, +3, +4
Oxider (basicitet): Amfoterisk
Elektronegativitet (Paulingskalan): 1,3
Kristallstruktur: Hexagonal
Ljudhastighet: 3 010 m/s
Termisk expansion: 5.9 µm/(m⋅K) (at 25 °C)
Värmeledningsförmåga: 23.0 W/(m⋅K)
Elektrisk resistivitet: 331 nΩ⋅m (at 20 °C)
Elektrisk konduktivitet: 3,12 × 106 A/(V × m)
Magnetism: Paramagnetisk
Magnetisk susceptibilitet: +75.0×10−6 cm3/mol (at 298 K)
Youngs modul: 78 GPa
Skjuvmodul: 30 GPa
Bulks modul: 110 GPa
Poissons konstant: 0.37
Vickers hårdhet: 1520–2060 MPa
Brinells hårdhet: 1450–2100 MPa
Mohs hårdhet: 5,5
CAS-nummer: 7440-58-6
Namnursprung: Efter Hafnia. Latin for: Copenhagen, where it was discovered
Förutsägelse: Dmitri Mendeleev (1869)
Upptäckt och första isolering: Dirk Coster and George de Hevesy (1922)
| Isotop | Förekomst | Halveringstid (t1/2) | Sönderfall | Sönderfallsprodukt |
|---|---|---|---|---|
| 172Hf | syn | 1.87 y | ε | 172Lu |
| 174Hf | 0.16% | 2×1015 y | α | 170Yb |
| 176Hf | 5.26% | stable | ||
| 177Hf | 18.60% | stable | ||
| 178Hf | 27.28% | stable | ||
| 178m2Hf | syn | 31 y | IT | 178Hf |
| 179Hf | 13.62% | stable | ||
| 180Hf | 35.08% | stable | ||
| 182Hf | syn | 8.9×106 y | β− | 182Ta |
https://en.wikipedia.org/wiki/Isotopes_of_hafnium
Hafnium är ett silvergrått metalliskt grundämne med kemiskt tecken Hf. Hafnium används i bland annat radiorör och glödlampor. Det återfinns i olika zirkoniummineral. Namnet kommer av Hafnia, som är det latinska namnet för Köpenhamn.
Grundämnet upptäcktes där 1923 av Dirk Coster och George de Hevesy sedan Niels Bohr med utgångspunkt från sin atomteori 1922 hade förutsagt dess existens.
Hafnium absorberar neutroner bra och används ibland i kärnkraftverk för att absorbera neutroner. Det kan också användas i legeringar med bland annat järn och titan.
Ett hafnium-baserat material är kandidat för en High-K-isolering som kommer att användas i framtida generationers processorer. High-K (kappa) = hög dielektrisk konstant (relativ permittivitet).
Intel och IBM har forskat inom området och har funnit att hafnium-baserade material är bättre isolatorer än kiseldioxid, vilket gör att man kan producera chip som är snabbare, mindre och mer energisnåla. Intel har nu börjat tillverka 45-nanometersprocessorer med hafnium.
Hafnium separeras från zirkonium (som har liknande egenskaper) genom vätske-vätske-extraktion.
I naturen förekommer hafnium i olika zirkoniummineral.

| H-fraser | H228 |
| P-fraser | P210, P240, P241, P280, P370 + P378 |

70. Ytterbium (Yb) <— 71. Lutetium (Lu) —> 72. Hafnium (Hf)
https://sv.wikipedia.org/wiki/Lutetium
https://en.wikipedia.org/wiki/Lutetium
Relativ atommassa: 174,967 u
Utseende: Silvervit
Densitet (vid rumstemperatur): 9.841 g/cm3
Densitet (vid smältpunkten): 9.3 g/cm3
Aggregationstillstånd: Fast
Smältpunkt: 1 936 K (1 663 °C)
Kokpunkt: 3 668 K (3 395 °C)
Molvolym: 17,78 × 10-6 m3/mol
Smältvärme: 18,6 kJ/mol
Ångbildningsvärme: 355,9 kJ/mol
Molär värmekapacitet: 26.86 J/(mol·K)
Atomradie: empirical: 174 pm
Kovalent radie: 187±8 pm
Elektronkonfiguration: [Xe] 4f14 5d1 6s2
e− per skal: 2, 8, 18, 32, 9, 2
Oxidationstillstånd: 0, +1, +2, +3
Oxider (basicitet): Svag basisk oxid
Elektronegativitet (Paulingskalan): 1,27
Elektronegativitet (Allenskalan):
Kristallstruktur: Hexagonal
Termisk expansion: poly: 9.9 µm/(m⋅K) (at r.t.)
Värmeledningsförmåga: 16.4 W/(m⋅K)
Elektrisk konduktivitet: 1,85·106 A/(V × m)
Elektrisk resistivitet: poly: 582 nΩ⋅m (at r.t.)
Magnetism: Paramagnetisk
Youngs modul: 68.6 GPa
Skjuvmodul: 27.2 GPa
Bulks modul: 47.6 GPa
Poissons konstant: 0.261
Vickers hårdhet: 755–1160 MPa
Brinells hårdhet: 890–1300 MPa
CAS-nummer: 7439-94-3
Namnursprung: Efter Lutetia, Latin for: Paris, in the Roman era
Upptäckt: Carl Auer von Welsbach and Georges Urbain (1906)
Första isolation: Carl Auer von Welsbach (1906)
| Isotop | Förekomst | Half-life (t1/2) | Decay mode | Product |
|---|---|---|---|---|
| 173Lu | {syn} | 1.37 y | ε | 173Yb |
| 174Lu | {syn} | 3.31 y | ε | 174Yb |
| 175Lu | 97.401% | Stabil | ||
| 176Lu | 2.599% | 3.78×1010 y | β− | 176Hf |
https://en.wikipedia.org/wiki/Isotopes_of_lutetium
Lutetium är ett grundämne som tillhör de sällsynta jordartsmetallerna. I enlighet med sin placering i det periodiska systemet tillhör lutetium övergångsmetallerna, men på grund av sina egenskaper placeras ämnet ofta bland lantanoiderna.
Ämnet kallades tidigare, särskilt i tysk litteratur, cassiopeium med kemiskt tecken Cp.
Namnet Lutetium kommer av Lutetia, det forntida namnet på Frankrikes huvudstad Paris; grundämnet upptäcktes 1907 av fransmannen Georges Urbain och oberoende av honom av österrikaren Auer von Welsbach.
I naturen förekommer lutetium i blandning med andra lantanoider, främst i mineralen monazit och gadolinit. Halten i jordskorpan är 0,8 ppm.
Den radioaktiva isotopen lutetium-177 kan användas för behandling av cancer. Genom att koppla lutetium-177 till bärarmolekylen oktreotat kan sammansättningen (kallad 177Lu-DOTATATE) användas för behandling av neuroendokrina tumörer.

| H-fraser | H228 |
| P-fraser | P210 |
Copyright © 2025 · Decor Theme on Genesis Framework · WordPress · Log in
Kommentarer