
45. Rodium (Rh) <— 46. Palladium (Pd) —> 47. Silver (Ag)
https://sv.wikipedia.org/wiki/Palladium
https://en.wikipedia.org/wiki/Palladium
Generella egenskaper
Relativ atommassa: 106,42 u
Utseende: Silvrigt vit metallisk
Fysikaliska egenskaper
Densitet (vid rumstemperatur): 12.023 g/cm3
Densitet (vid smältpunkten): 10.38 g/cm3
Aggregationstillstånd: Fast
Smältpunkt: 1 828,05 K (1 554,90 °C)
Kokpunkt: 3 236 K (2 963 °C)
Molvolym: 8,56 × 10-6 m3/mol
Smältvärme: 17,6 kJ/mol
Ångbildningsvärme: 357 kJ/mol
Molär värmekapacitet: 25.98 J/(mol·K)
Atomära egenskaper
Atomradie: 140 (169) pm
Kovalent radie: 131 pm
van der Waalsradie: 136 pm
Elektronkonfiguration
Elektronkonfiguration: [Kr] 4d10
e− per skal: 2, 8, 18, 18, 0
Kemiska egenskaper
Oxidationstillstånd: 0, +1, +2, +3, +4
Oxider (basicitet): Mild bas
Elektronegativitet (Paulingskalan): 2,20
Elektronegativitet (Allenskalan):
Diverse
Kristallstruktur: kubisk tätpackning (ccp)
Ljudhastighet: 3 070 m/s
Termisk expansion:
Värmeledningsförmåga:
Elektrisk konduktivitet: 9,5 × 106 A/(V × m)
Elektrisk resistivitet:
Magnetism: Paramagnetisk
Magnetisk susceptibilitet: +567,4×10−6 cm3/mol (288 K)
Youngs modul: 121 GPa
Skjuvmodul: 44 GPa
Bulks modul: 180 GPa
Poissons konstant: 0.39
Mohs hårdhet: 4,75
Vickers hårdhet: 400–600 MPa
Brinells hårdhet: 7440-05-3
Identifikation
CAS-nummer: 7440-05-3
Historia
Namnursprung: Efter asteroiden Palla, vilket kommer från Pallas Athena.
Upptäckt och första isolation: William Hyde Wollaston (1802)
Isotoper
| Isotop | Förekomst | Halveringstid (t1/2) | Sönderfall | Sönderfallsprodukt |
|---|---|---|---|---|
| 100Pd | syn | 3.63 d | ε γ | 100Rh |
| 102Pd | 1.02% | Stabil | ||
| 103Pd | {syn} | 16.991 d | ε | 103Rh |
| 104Pd | 11.14% | Stabil | ||
| 105Pd | 22.33% | Stabil | ||
| 106Pd | 27.33% | Stabil | ||
| 107Pd | Spår | 6.5×106 y | β− | 107Ag |
| 108Pd | 26.46% | Stabil | ||
| 110Pd | 11.72% | Stabil |
https://en.wikipedia.org/wiki/Isotopes_of_palladium
Palladium
Palladium är ett metalliskt grundämne som tillhör gruppen lätta platinametaller. Det upptäcktes 1803 av William Hyde Wollaston och uppkallades efter den 1802 upptäckta asteroiden Pallas.
Egenskaper
Palladium är mycket korrosionsbeständigt och räknas kemiskt som en ädelmetall. Den är en silvervit och utomordentligt smidbar metall. Den angrips inte av luft eller svavelväte men löses av salpetersyra och svavelsyra.
Vid rumstemperatur kan metallen i kompakt form lösa 900 gånger sin egen volym vätgas och i kolloidal form 3 000 gånger. Det upplösta vätet är synnerligen reaktivt (atomärt), och finfördelad palladium utgör därigenom en effektiv katalysator för hydrering.
Organiska föreningar
Palladiumorganiska föreningar är komplex, bildade ur oorganiska palladiumföreningar och omättade organiska ämnen. De är i allmänhet instabila och vid deras sönderfall bildas ofta andra ämnen än utgångsmaterialen. Oorganiska palladiumföreningar katalyserar på så sätt vissa reaktioner inom organisk kemi.
Förekomst
I naturen förekommer palladium i gedigen form med andra platinametaller i flodsandavlagringar i bland annat Brasilien och Ryssland.
Användning
Enligt en svensk lag från 1999 stadgas att man kan få tillstånd att sälja arbeten av palladium som ädelmetallarbeten. I legering med guld, platina eller silver används palladium till smycken, tandfyllningar samt inom elektronik och för katalysatorer.

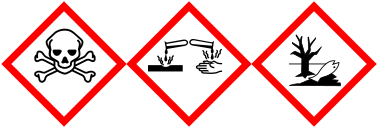
| H-fraser | H228 |
|---|---|
| P-fraser | P210 |
http://www.periodicvideos.com/
























Kommentarer